
对食物缺少正常的免疫耐受性与食物过敏(如花生、鸡蛋和牛奶)和乳糜泻是明显相关。目前尚不清楚保护性免疫是如何被诱导对抗病原体,同时仍保持对食物的免疫耐受的,对这些过程的深入了解将有助于开发针对肠道感染、炎症和过敏状况的治疗方法。目前免疫耐受的研究主要集中在大肠中的共生细菌上,并涉及抗原呈递细胞,如CD103+树突状细胞(DC)和ILC3s,诱导具有调节功能的T细胞,但对食物免疫耐受的机制研究较少。
2023年7月,中国科学技术大学朱书教授团队和耶鲁大学医学院 Richard A. Flavell 教授联合在顶刊Cell(Q1,IF 64.5)上发表了题为“Gasdermin D licenses MHCII induction to maintain food tolerance in small intestine”的文章。该研究发现肠上皮细胞(IECs)积累了一个不易识别的GSDMD的13kD N端片段,该片段在响应膳食抗原时被caspase-3/7裂解。与30kD GSDMD裂解片段不同,IEC积累的GSDMD裂解片段易位到细胞核,诱导CIITA和MHCII分子的转录,进而诱导上小肠的Tr1细胞凋亡。用caspase-3/7抑制剂处理的小鼠、抗caspase-3/7裂解的GSDMD突变小鼠、IECs中MHCII缺乏的小鼠和Tr1缺乏的小鼠都表现出食物耐受表型的破坏。所以研究GSDMD的差异裂解可以作为控制小肠免疫与耐受的调节枢纽。中科新生命为该研究提供了蛋白质组学技术服务。

小鼠、细胞
技术路线
步骤1:膳食抗原在小肠中诱导非细胞焦亡的13kD GSDMD片段;
步骤2:Caspase-3和caspase-7在IECs中裂解GSDMD;
步骤3:核定位的GSDMD片段协助STAT1诱导IECs中的CIITA和MHCII;
步骤4:核定位的GSDMD片段调节IECs中的MHCII诱导Tr1细胞;
步骤5:在IECs中食物诱导的GSDMD裂解失活会破坏对食物的免疫耐受。
研究结果
1. 膳食抗原在小肠中诱导非细胞焦亡的13kD GSDMD片段
在本研究中,作者用免疫印迹法对肠、胃,淋巴组织和其他器官,包括肺、肝、胰、脑和脊髓进行鉴定,发现全长形式的GSDMD (55 kD),在小肠IEC样本中意外地观察到了13kD GSDMD条带(Figure 1A)。作者想知道GSDMD是否在小肠中发挥某些非细胞焦亡作用。对13kD GSDMD片段进一步研究,利用两个GSDMD敲除小鼠品系,其中将FLAG-标签融合到GSDMD的N末端或HA-标签融合到C末端(Figure 1B和1D)。在这些标记的GSDMD敲除小鼠品系的上小肠中观察到大小相似的13kD GSDMD条带(GSDMD-N13)和相应的GSDMD C末端片段(GSDMD-C42)(Figure 1C和1E),说明GSDMD可能裂解为13和42kD片段。接下来,GSDMD-N13片段的信号在IEC中表达明显(Figure 1F)。这些数据表明,在触发和功能未知的IEC中,GSDMD可能在小肠上部发生13/42裂解。为了探索触发小肠上部GSDMD13/42裂解的潜在因素,作者从肠中依次分析了单个环境成分的影响。结果表明抗生物药(ABX)或抗病毒鸡尾酒(AVC)治疗、微生物信号或胆汁酸(Figure 1G)和是否有病原体(Figure 1H)均不影响GSDMD-N13和全长GSDMD的分布。考虑到消化道该部位存在丰富的营养物质,推断食物成分可能诱发了该片段。基于用不同类型的食物喂养小鼠的筛选显示,与使用不含完整蛋白质的氨基酸食物(AAD)喂养的动物相比,使用正常食物喂养的动物的GSDMD- N13水平显著更高(Figure 1I),其被特异性地形成为缺乏蛋白质类食物抗原。因此,研究结果表明蛋白性膳食抗原而非共生抗原在上小肠上皮细胞中诱导非细胞焦亡13kD GSDMD片段。
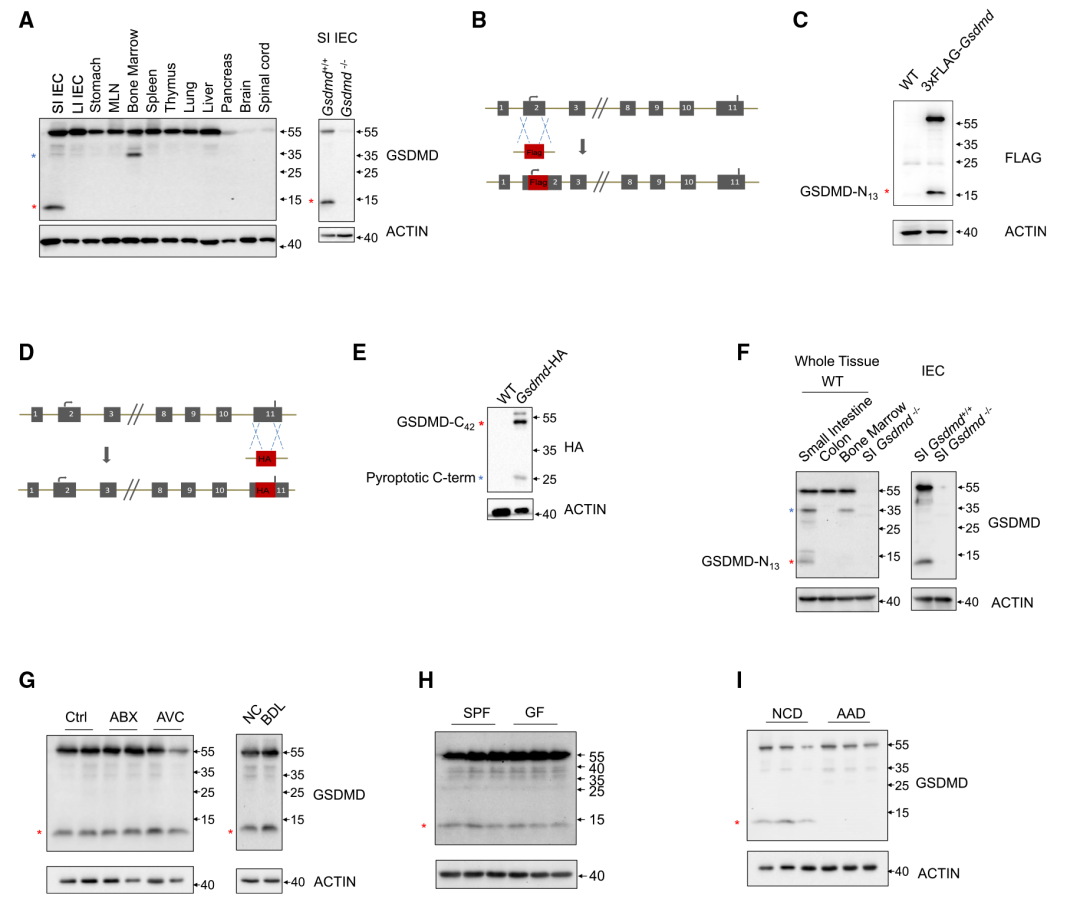
Figure1 膳食抗原在小肠上部诱导非细胞焦亡的13kD GSDMD片段
2.Caspase-3和caspase-7在IECs中裂解GSDMD
作者随后进行了质谱分析(IP-MS),以确定可能的蛋白酶(一种或多种)裂解GSDMD的13/42,通过对MS结果进行分析,在考马斯氏染色的SDS-PAGE中,蛋白酶如caspase (CASP)-3、CASP-7和CASP-1被指定为凝胶带的最佳候选物(Figure 2AB),CASP-1在BM细胞中中度表达(在此处检测到大量30/25 GSDMD裂解),但在IEC中仅表现出弱表达,CASP-3和CASP-7在IEC中强表达,而在BM细胞中未表达(Figure 2C)。同时还发现CASP-3和CASP-7表达(以及GSDMD-N13片段)发生在小肠上部,包括十二指肠和空肠,一个充满膳食抗原的区域,不发生在小肠或结肠远端(Figure 2D)。CASP-7或CASP-3的过表达导致HEK293T细胞中13/42 GSDMD裂解(Figure 2E),用CASP-3/7抑制剂Ac-DEVD-CHO处理共表达GSDMD和CASP-7的HEK-293T细胞,未检测到GSDMD-N13片段(Figure 2F)。此外,体内实验显示,连续4天腹腔内注射Ac-DEVD-CHO可降低来自小肠上部的IEC中CASP-3和CASP-7的表达以及GSDMD的13/42N-末端裂解程度(Figure 2G),证实CASP-3和CASP-7是能够在体外和体内催化13/42 GSDMD裂解的蛋白酶。
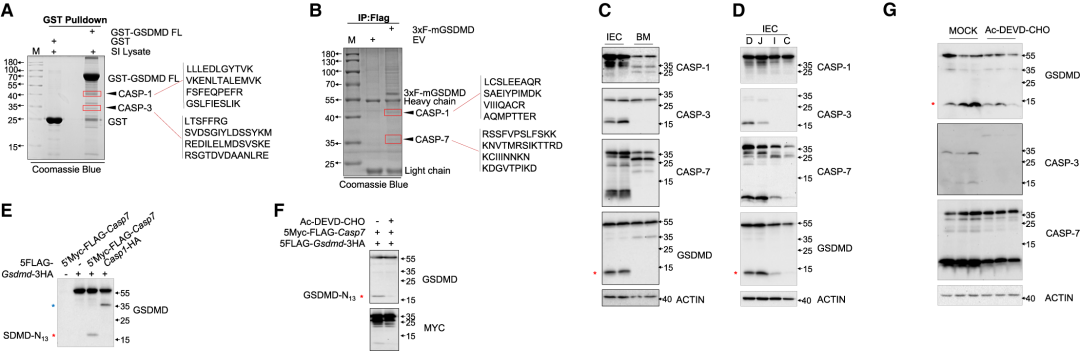
Figure2 Caspase-3和caspase-7在IECs中裂解GSDMD
3. 核定位的GSDMD片段协助STAT1诱导IECs中的CIITA和MHCII
作者进一步研究了IEC中13/42 GSDMD裂解产生的潜在生理变化。首先生成了重组GSDMD的片段,包括响应膳食抗原而裂解的GSDMD- N13片段(1-88 aa),以及相应的GSDMD- C42片段(89-487 aa)。检测这些重组GSDMD截断变体的亚细胞定位:GSDMD- C42定位在细胞质中(Figure 3A)。与GSDMD-N30不同,GSDMD-N30定位于引发细胞焦亡的细胞膜,而GSDMD-N13则定位于细胞核(Figure 3A、3B)。此外,在用上述AAD替代正常食物后,检测到IECs中核定位的GSDMD片段的程度显著降低,以及CASP-7的激活(Figure 3C),这表明膳食抗原诱导了GSDMD- N13的核易位。
作者通过产生三种小鼠品系(GSDMD完全敲除小鼠(Gsmdmd-/-)、IEC中GSDMD特异性缺陷小鼠(GsdmdΔIEC)和携带小肠13/42裂解抗性GSDMD变体的小鼠(GsdmdSICR))探索了哪些途径可能受到IEC核GSDMD-N13的影响。首先研究团队分析了来自GSDMD-/-和同窝WT小鼠小肠上部的IEC转录组。基因本体(GO)分析表明,在IEC中富集了与抗原加工和呈递相关的差异调控基因,编码主要组织相容性复合体II类(MHCII)分子的基因以及被广泛认为是MHCII分子表达的“主控因子”的Ciita(Figure 3D - 3G)的富集程度尤其高。
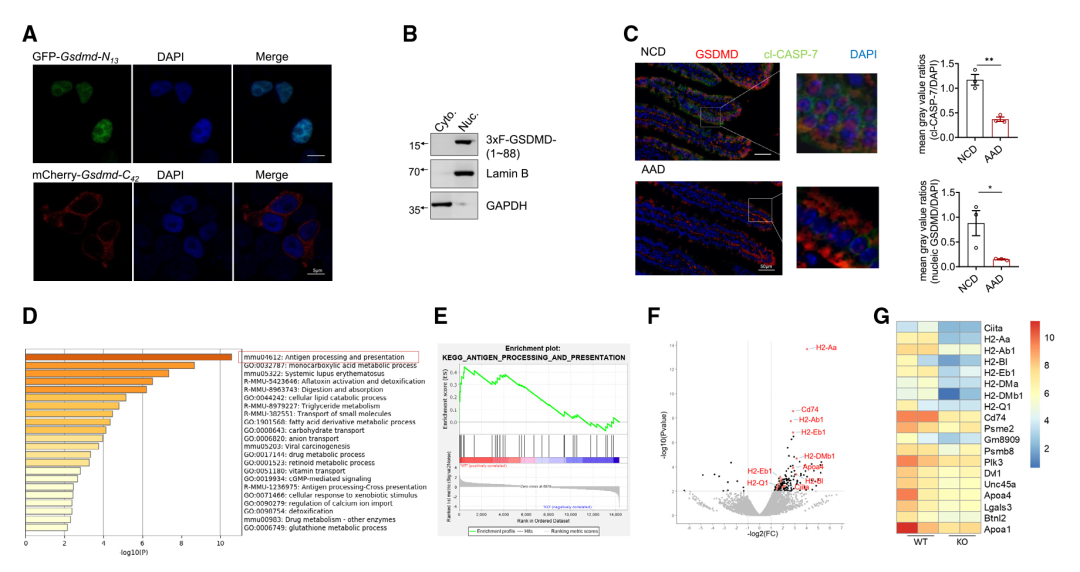
Figure3 核定位的GSDMD片段协助STAT1诱导IECs中的CIITA和MHCII
4. 核定位的GSDMD片段调节IECs中的MHCII诱导Tr1细胞
随后进行了单细胞RNA测序(scRNA-seq),以分析GsdmdSICR小鼠和相应的仔鼠对照中的基质和免疫细胞群体。上小肠细胞的无监督聚类显示基于其特定基因表达谱的23个不同聚类(Figure 4A)。Ep-cam(编码EpCAM)和Ptprc(编码CD45)的表达分别表明了上皮细胞和免疫细胞,WT IECs显示了Gsdmd的富集表达(在簇4和簇5中表达最高),还检测到GsdmdSICR小鼠的几个细胞簇(如肠细胞和肠干细胞[ISC])中的MHCII分子表达与其WT同窝小鼠相比显著降低(Figure 4B),并注意到MHCII分子在专门的IEC中几乎不表达。重要的是为GSDMD-N13与MHCII表达之间的功能关联提供进一步支持—在稳态下高水平表达MHCII分子的典型抗原致敏细胞类型(如B细胞、巨噬细胞或DC)中,未检测到突变基因型与WT同窝动物之间的MHCII分子表达发生变化(Figure 4B),从scRNA-seq进一步证实,GSDMD-N13特异性调节稳态IEC中MHCII分子的表达水平,但不调节髓样细胞中的表达水平。观察到GSDMD 13/42切割失活导致小肠上部的Tr1细胞(CD4+IL-10+Foxp3-)减少,但未导致Treg细胞(CD4+Foxp3+)减少(Figure 4C),qPCR分析显示,与WT同窝仔鼠相比,来自GsdmdSICR小鼠小肠上部固有层淋巴细胞(LPL)的分选CD4+ T细胞中Il-10表达显著降低,与WT同窝仔对照组相比(Figure 4D),由于稳态下小肠中的细胞IL-10蛋白水平无法通过细胞内FACS染色进行评估,作者将IL-10-GFP报告小鼠与GsdmdSICR小鼠或与H2-Ab1ΔIEC小鼠杂交。然后,从所得子代的十二指肠中分离LP,与相应的WT同窝仔鼠相比,在GsdmdSICR小鼠和H2-Ab1-ΔIEC小鼠中CD4+IL-10-GFP+细胞的数量和百分比均显著降低(Figure 4E和4F)。CD4+Foxp3+和CD4+Foxp3+Rorγt+ 细胞群不受IEC中GSDMD-N13或MHCII分子丢失的影响(Figure 4E和4F)。这些结果表明,IEC中的GSDMD-N13-MHCII轴支持小肠上部的Tr1细胞群。
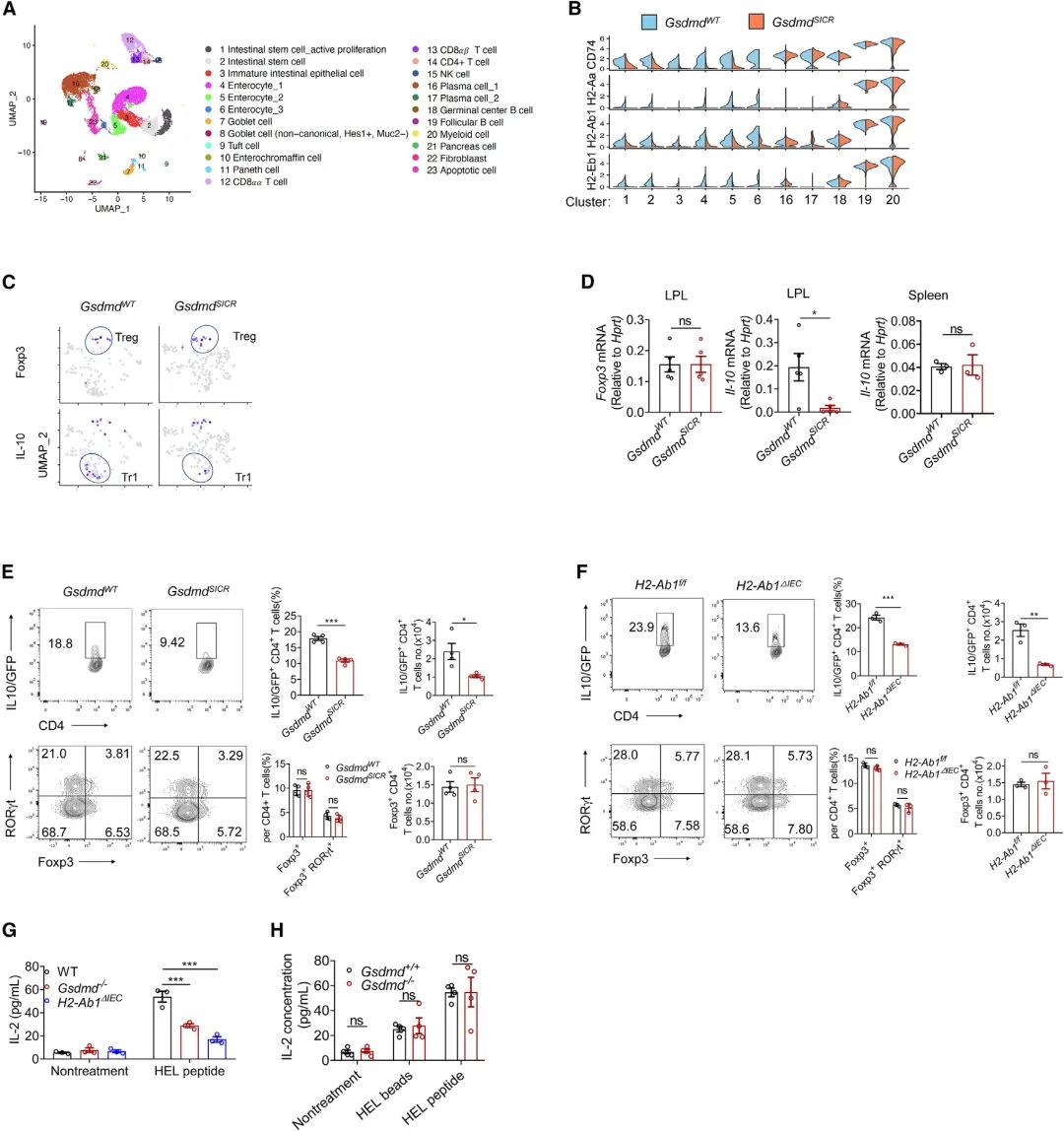
Figure4 核定位的GSDMD片段调节IEC中的MHCII效应以诱导Tr1细胞
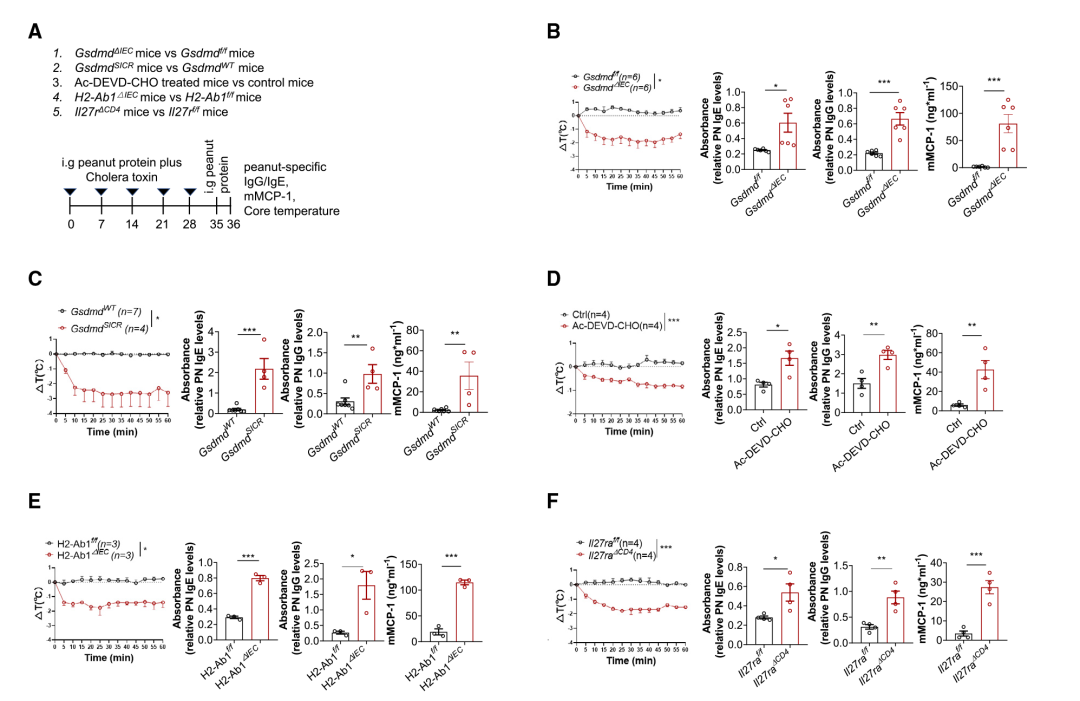
igure5 T GSDMD KO或IECs中抗切割的GSDMD变体会破坏对食物的免疫耐受
文章小结
