本期解读
题目:Tumor endothelial cell-derived cadherin-2 promotes angiogenesis and has prognostic significance for lung adenocarcinoma
期刊:Molecular Cancer
影响因子:10.679
01、研究背景
肺癌是最常见的恶性肿瘤之一,严重威胁着人类的生命和健康。1971年,Folkman等提出了肿瘤生长依赖于血管生成的假说,当肿瘤直径达到一定大小时,就会启动“血管生成开关”,促进新的血管生成,以保证肿瘤生长的血供需求。肿瘤血管生成是一个极其复杂的过程,受多种血管生成因子的调控。因此,抑制血管生成过程中关键步骤,阻断肿瘤血管生成,成为近年来肺癌治疗的新策略。
文章通过iTRAQ-2DLC-MS蛋白质组学技术进行抗血管生成基因靶点筛选,选取肺癌组织癌及癌旁分离获得的内皮细胞ECs作为研究材料,并经IHC免疫组化验证最终确认血管钙黏蛋白Cadherin-2(CDH2),其在肺癌中显著上调。通过构建CDH过表达及干扰基于细胞水平对CDH2促血管生成功能进行研究,临床数据结合显示CDH2的高表达与腺癌(ADC)的肿瘤分期、肺胸膜转移、ADC患者的总生存期降低有显著相关性,而在鳞状细胞癌(SCC)中无相关性。实验证明CDH2在血管生成中的重要性,阐述了其在抗血管生成治疗及作为腺癌(ADC)候选预后标志物的潜力。
02、研究内容及结果
1. 基于iTRAQ分析的EC蛋白表达谱
1.1 分离血管内皮细胞ECs标记物鉴定
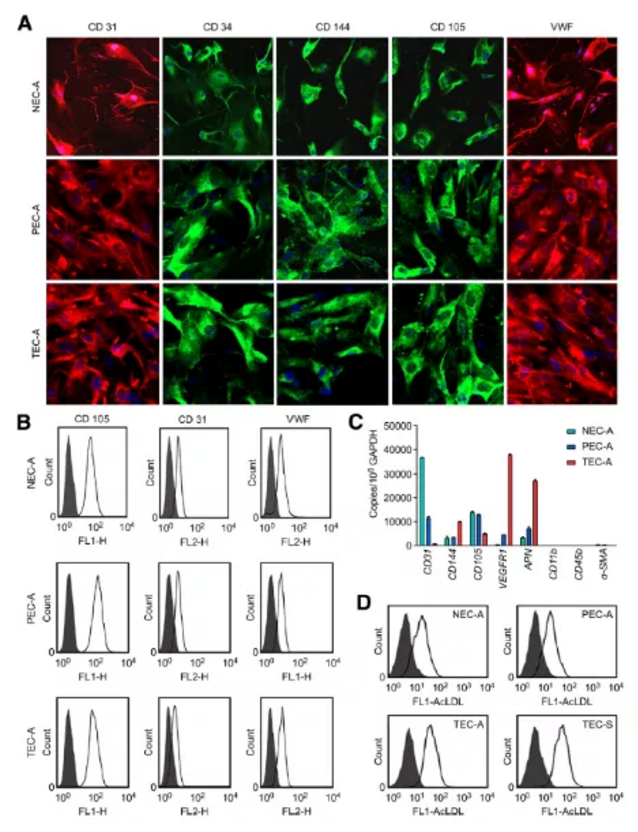
作者从ADC肺癌临床组织进行内皮细胞分离工作,并根据离癌组织远近分别将所分离细胞命名为:TECA(癌组织分离血管内皮细胞)、PECA(癌旁组织分离血管内皮细胞)及NECA(正常组织分离血管内皮细胞)。并采用免疫荧光染色和流式细胞分析对获取内皮细胞进行鉴定。结果如下图所示:
Figure1. 正常组织、癌旁及肿瘤来源的ECs中内皮细胞标志物的表达及AcLDL的摄取检测
a. 免疫荧光检测阳性:CD31(红色标记)、CD34(绿色标记)、CD144(绿色标记)、CD105(绿色标记)、VWF(红色标记),细胞核DAPI染色(蓝色标记)
b. 流式细胞仪检测ECs标记物(CD31、VWF)及微血管内皮细胞标记物(CD105)阳性
c. qPCR检测CD105、CD31、CD144、VEGFR1、APN、CD11b及a-SMA基因基因表达水平
d. 流式检测AcLDL内吞摄取(既往研究常以吞噬Dil标记乙酰化低密度脂蛋白能力作为鉴定EPCs的一个重要指标)
小结:分离正常组织、癌旁组织及肺癌肿瘤组织来源的血管内皮细胞经鉴定:CD31、CD34、CD144、CD105及VWF阳性(Figure1A所示),血管平滑肌标记a-SMA及单核细胞标记CD11b和CD45b阴性(Figure1C所示),AcLDL吞噬能力检测阳性。
1.2 iTRAQ鉴定及功能检测实验
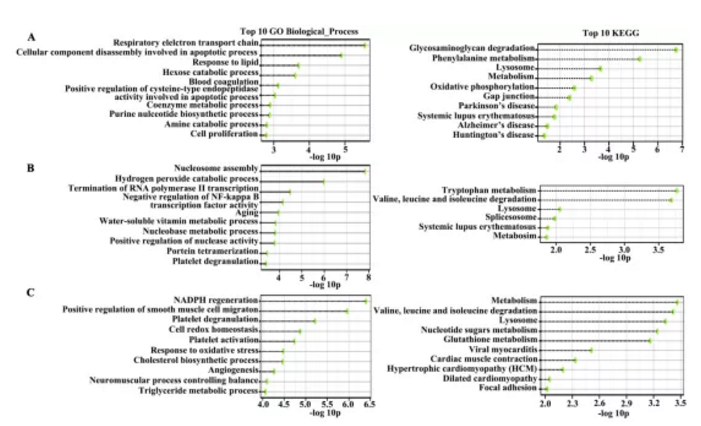
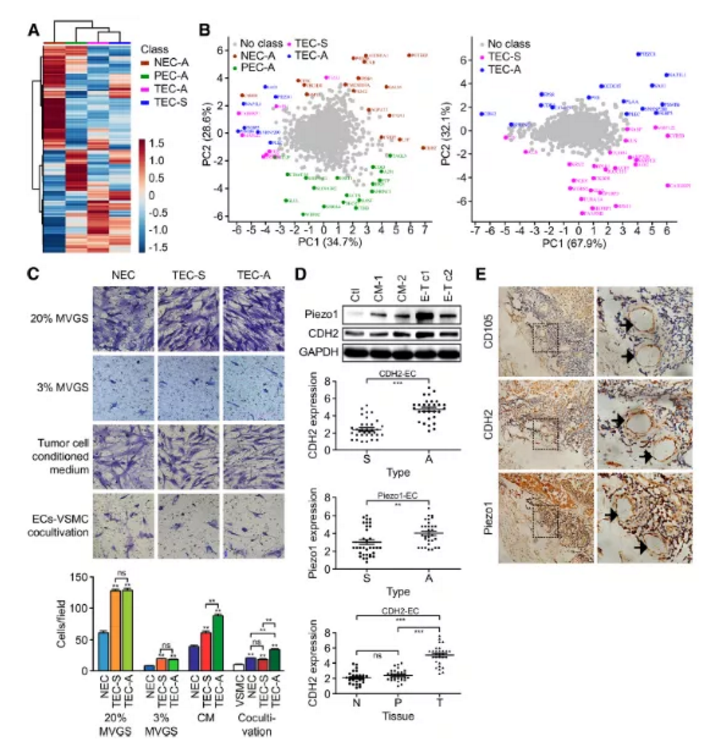
4组细胞样品,NECA(正常组织分离血管内皮细胞)、PECA(癌旁组织分离血管内皮细胞)、TECA(恶性腺瘤癌组织分离血管内皮细胞)及TEC-S(鳞状细胞癌组织分离血管内皮细胞)通过iTRAQ蛋白质组学检测,经生物信息学分析共鉴定到1820个差异蛋白。文章通过对差异蛋白GO及KEGG富集分析(FigureS1),筛选出81个蛋白可能参与转录调控、蛋白组装、NF-KB转录调控及过氧化氢分解代谢等生物学过程,并对4组样品差异蛋白进行聚类热图分析及主成份分析(Fig2a&2b)。
Figure S1:基因功能富集分析及Top10 pathway展示(GO及KEGG富集)
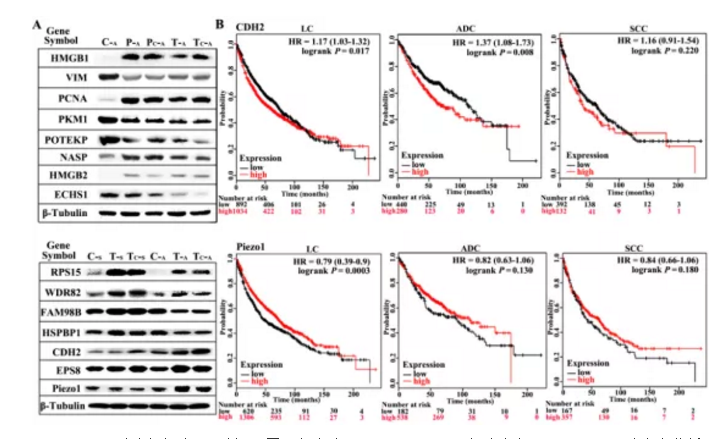
为进一步筛选确认与肺癌相关差异蛋白,作者将TECA及TECs组共有差异蛋白进行富集分析,并挑选出差异显著性最大的15个蛋白用Western blotting方式进行差异验证,结果如figS2所示,验证结果显示在肺腺癌(ADC)及肺鳞癌(SCC)中显示差异蛋白表达趋势相同。
Figure S2. 肺癌组织中WB验证不同蛋白表达及CDH2及Piezo1在肺癌中Kaplan-Meier 法生存分析
2. 不同肺癌类型来源血管内皮细胞ECs的异质性研究
2.1 Transwell检测迁移
血管内皮细胞EC迁移和平滑肌细胞的正向调控是血管生成的两个重要生物学过程。文章中通过设置不同类型的诱导培养基,研究正常血管内皮细胞(NEC)、ADC来源血管内皮细胞(TECA)及SCC来源血管内皮细胞(TECS)迁移速率变化,作者发现(Fig.2c):
(1)在包含20%或3%MVGS(血管生长因子添加剂)M131培养基培养条件下,TECA及TECS相较于NEC细胞迁移速率整体上要快(P<0.01)
(2)在肿瘤细胞培养基CM培养条件下,与TECs组相比,TECA组细胞迁移速率更快(P<0.01)
2.2 qPCR检测Peizo1和CDH2表达
与ADC细胞系SPC-A-1共培养的原代人脐静脉内皮细胞(HUVECs)中, Peizo1和CDH2的表达水平升高,而与SCC细胞系共培养的HUVECs细胞中Peizo1和CDH2的表达水平不升高(Fig.2d)。肺腺癌ADC临床样品相对于肺鳞癌SCC样品IHC免疫组化阳性率更高(Fig.2e)。
小结:这些数据表明,CDH2在ADC的标记物开发中可能比SCC扮演更重要的功能角色。
Figure 2. CDH2及Piezo1蛋白在ADC及SCC来源的血管内皮细胞中的表达模式及异质性研究
a. NECA、PECA、TECA及TECS样品蛋白表达模式聚类分析,红色代表蛋白上调,蓝色代表下调
b. PCA主成份分析,主成份用相应的名称和基因团颜色标记
c. 迁移实验
d. ADC来源的血管内皮细胞及SCC来源的血管内皮细胞中CDH2及Piezo1基因表达异质性分析
e. 临床肺癌患者(36例SCC,32例ADC)肿瘤内皮细胞中CD105、CDH2及Piezo1免疫组化检测
3. CDH2对血管再生功能研究
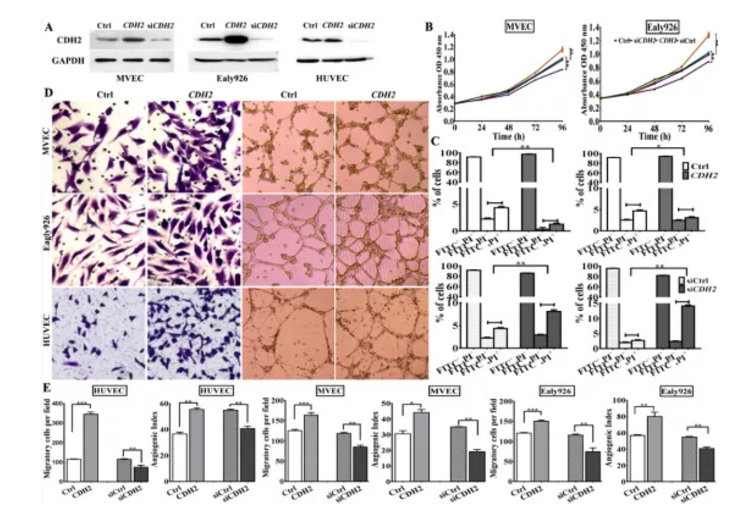
为进一步研究CDH2在肿瘤生成过程功能,作者构建了CDH2过表达质粒及siCDH2干扰,经过表达及干扰效果验证后,检测其对血管生成相关指标进行检测,结果显示:过表达CDH2能显著促进EC细胞增殖、迁移及血管生成;沉默CDH2基因表达后正好相反(Figure S3)。
Fig S3. 过表达及干扰体外检测CDH功能
a. Western blotting检测CDH2过表达及干扰效果
b.&c. CDH2过表达及干扰后MEVCs及Ealy926细胞增殖及凋亡检测
d&e. CDH2过表达及干扰后MEVCs、Ealy926及HUVEC细胞迁移迁移及体外血管生成活性检测
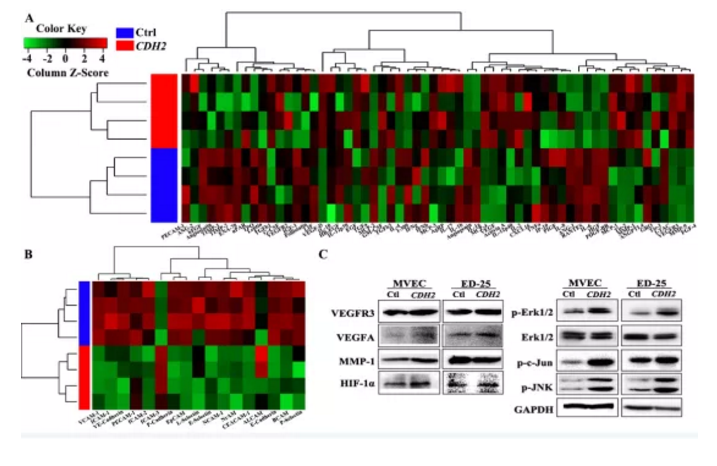
4. CDH2对血管再生影响机制探讨
CDH2过表达后,经Western blotting检测发现:
(1)上皮细胞标志物(E-cadherin、EpCAM及P-cadherin)、神经和基底细胞粘附分子(NCAM-1、NrCAM和BCAM)、白细胞粘附分子(L-,E-,P-selectin)及特异性粘附分子(VE-caherin)均下调;
(2)迁移调控相关蛋白(RANTES、ENA-78、IL-6、MCP-2和IP-1a)也显著下调;
(3)VEGFR信号通路中涉及到的3种蛋白(VEGFA、VEGFD及VEGFR3),发现其显著上调
(4)磷酸化水平两个主要MAPK信号通路蛋白ERK及MAPK及JNK显著上调
小结:CDH2通过调控MAPK/ERK及MAPK/JNK信号通路相关蛋白变化进而促进血管生成
Figure S5. CDH2介导血管生成机制相关通路蛋白检测
a&b. 筛选血管生成相关差异蛋白heatmap热图
c. Western blotting检测通路相关蛋白
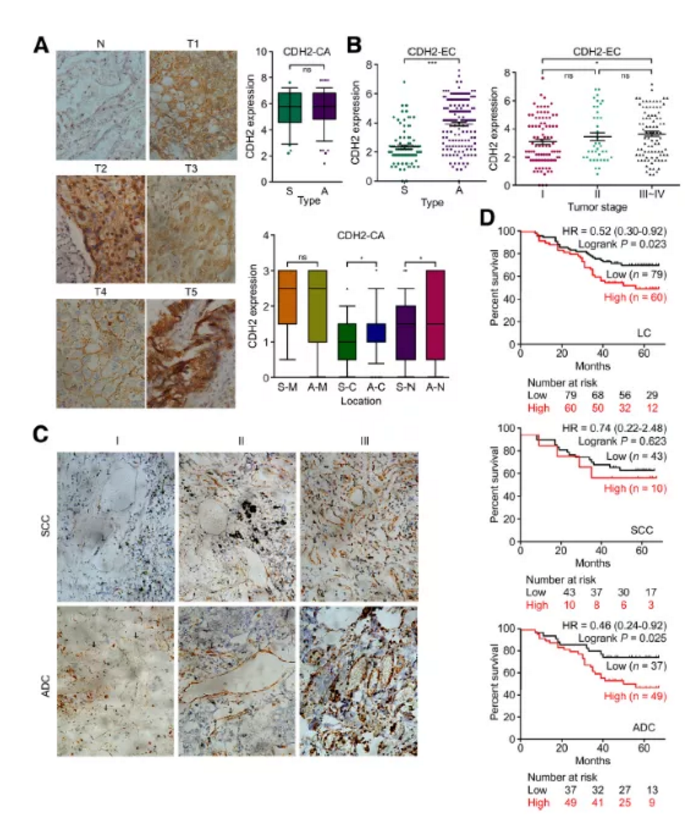
5. CDH2应用临床价值评估
作者搜集临床218例肺癌及邻近对照组织进行IHC检测,结果显示临床正常组织中CDH2表达较少,在肺癌组中肿瘤细胞中检测呈现极强的阳性(Fig3a)。肺鳞癌SCC及肺腺癌ADC样本中整体表达无明显差异,但其在不同类型癌细胞中定位不同。通过IHC染色强度评估,进一步在细胞膜、细胞质和细胞核中进行表达分析发现,与鳞状细胞癌SCC相比,ADC肺腺癌CDH2在细胞质及细胞核中的表达显著提高(P<0.05)。
小结:CDH2裂解及表达的异质性导致了与癌细胞粘附和细胞迁移/增殖相关的不同调控行为。
Figure3. IHC分析218例肺癌患者肿瘤组织中CDH2表达
a. IHC检测正常组织及肿瘤癌组织CDH2表达
b&c. IHC检测ADC及SCC癌组织中CDH2表达
d. 生存分析预测检测分析
03、小结
文章阐明了ADC来源的血管内皮细胞ECs的蛋白组学特征,证实了在TECA(肿瘤来源内皮细胞)组中唯一上调的CDH2基因可促进体内外血管生成。MAPK/ERK及MAPK/JKN信号通路相关蛋白在CDH2诱导血管生成过程中起重要调节作用。进一步证实CDH2表达与肿瘤分期、肺胸膜转移、ADC患者的生存预期相关,与SCC无关。研究数据为证实CDH2在血管生成重要作用及机制调控提供理论依据,证实其作为新的分子结合靶点标记物奠定基础。
04、参考文献
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394–424.
2. Liu YR, Guan YY, Luan X, Lu Q, Wang C, Liu HJ, Gao YG, Yang SC, Dong X,Chen HZ, Fang C. Delta-like ligand 4-targeted nanomedicine for antiangiogenic cancer therapy. Biomaterials. 2015;42:161–71.
3. Durr E, Yu J, Krasinska KM, Carver LA, Yates JR, Testa JE, Oh P, Schnitzer JE. Direct proteomic mapping of the lung microvascular endothelial cell surface in vivo and cell culture. Nat Biotechnol. 2004;22:985–92.
4. Zhuo H, Lyu Z, Su J, He J, Pei Y, Cheng X, Zhou N, Lu X, Zhou S, Zhao Y. Effect of lung squamous cell carcinoma tumor microenvironment on the CD105+ endothelial cell proteome. J Proteome Res. 2014;13:4717–29.
更多文献解读
蛋白质专题系列讲座回放
05、金开瑞可提供